产品概述:
产品货号:M7415S, M7415M, M7415L, M7415XL
产品规格:1 mL, 5 mL, 60 mL, 450 mL
储存条件:在2~8℃下保存,有效期见外包装
产品介绍
本品采用超顺磁性微珠,配合优化的缓冲液体系,在特定比例的磁珠悬液中,将不同分子量的核酸片段回收,整个操作过程方便快速,其回收的核酸片段可用于二代测序平台的文库构建。本产品适合于回收150 bp~3000 bp长度的DNA,可手工实验操作,也可应用在基于自动化移液工作站的高通量实验操作。
实验步骤
一.使用前准备
1.80%(v/v)乙醇溶液(最好使用新鲜配置的)
2.10 mM Tris-HCl,pH 8.0
3.超纯水
4.1 mM EDTA
5.漩涡振荡器
6.磁性分离器:可选用UE磁性分离器,货号:M7429
注:DNA样本体积需≥50 μL。过小的体积会降低移液的准确度,从而影响筛选范围的准确度。
二.操作步骤
提前半小时将DNA片段筛选试剂从4℃取出,使其温度平衡至室温。
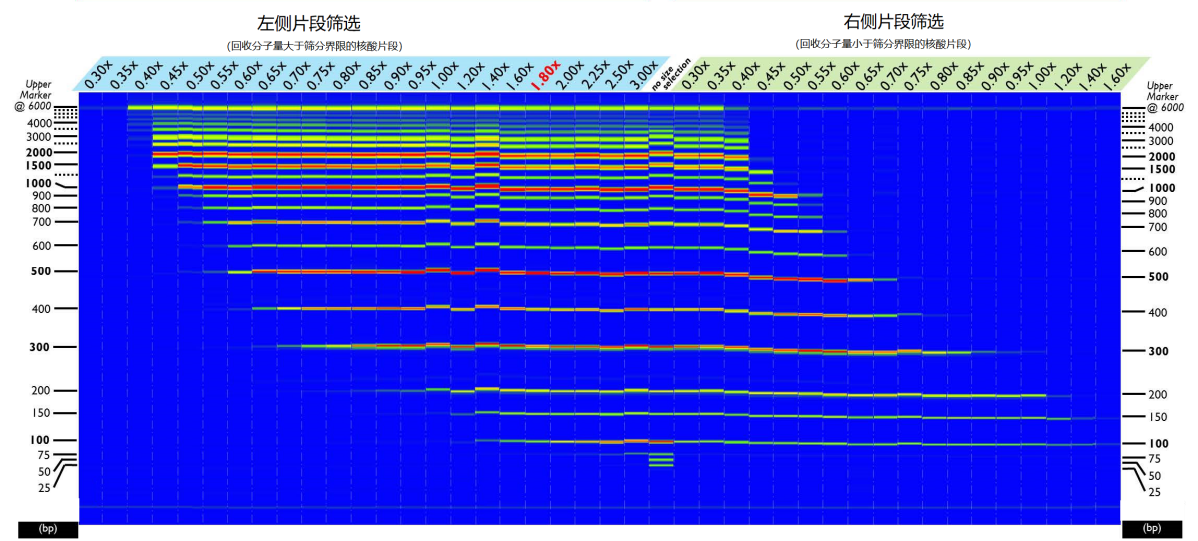
1.左侧片段筛选
用于回收分子量大于筛分界限的核酸片段,在该操作流程中,随着磁珠悬液与样本比率的增大,小片段核酸的结合效率会逐渐增大。
(1)结合:将50 μL样本加入到合适的离心管中,再根据图1加入特定体积的磁珠悬液,移液器吹打混匀10次或涡旋30 s,室温静置5 min;将离心管置于磁性分离器上至溶液变澄清,用移液器吸去上清。
注:样本量×比率=磁珠悬液加入量,如50 μL样本×0.6=30 μL磁珠悬液。
(2)洗涤:保持离心管于磁性分离器上,加入200 μL 80%乙醇,室温静置30 s后,用移液器吸去上清;重复该步骤一次。
注:最后一次洗涤后应尽可能移除干净洗涤液。
(3)干燥:保持离心管于磁性分离器上,风干至磁珠表面无明显光泽。
注:该步骤应避免磁珠干燥过度而影响洗脱效率。表面有裂纹即代表干燥过度。
(4)洗脱:向离心管中加入30~40μL超纯水、10 mM Tris-HCl或TE,用移液器反复吹打10次,使磁珠与溶液充分混匀
将反应管于室温静置3~5 min。再将离心管置于磁性分离器至溶液变澄清,将上清液转移至新的离心管中,可直接用于后续研究或者置于-20℃冰箱长期保存。
注:用户可根据实验需要调整洗脱液体积,但不低于20 μL。
2.右侧片段筛选
用于回收分子量小于筛分界限的核酸片段,在该操作流程中,随着磁珠悬液与样本比率的增大,大片段核酸的结合效率会逐渐降低,如图1右侧所示:
(1)一次结合:将50 μL样本加入到合适的离心管中(编号A),再根据图1加入特定体积的磁珠悬液,移液器吹打混匀10次或涡旋30 s,室温静置5 min;将离心管置于磁性分离器上至溶液变澄清,用移液器将上清转移至另一个新的离心管中(编号B),弃去磁珠。
注:样本量×比率=磁珠悬液加入量,如50 μL样本×0.6=30 μL磁珠悬液。
(2)二次结合:在上述离心管B中加入指定量(见备注)的磁珠悬液,漩涡震荡混匀后于室温下静置5min;将离心管置于磁性分离器上至溶液变澄清,用移液器吸去上清。
注:样本量×(1.8-比率)=磁珠悬液加入量,如50 μL样本×(1.8-0.6)=60 μL磁珠悬液。
(3)洗涤:保持离心管B于磁性分离器上,加入200 μL 80%乙醇,室温下静置30 s后,用移液器吸去上清;重复该步骤一次。
注:最后一次洗涤后应尽可能除尽洗涤液。
(4)干燥:保持离心管B于磁性分离器上,风干至磁珠表面无明显光泽。
注:该步骤应避免磁珠干燥过度而影响洗脱效率。
(5)洗脱:向离心管B中加入30~40μL超纯水、10 mM Tris-HCl或TE,用移液器反复吹打10次,使磁珠与溶液充分混匀,将反应管于室温静置3~5 min,再将离心管置于磁性分离器至溶液变澄清,将上清液转移至新的离心管中,可直接用于后续研究或者置于-20℃冰箱长期保存。
注:用户可以根据实验需要调整洗脱液体积,但不低于20 μL
3.两侧片段筛选
用于回收分子量处于特定范围的核酸片段,在该操作流程中,可通过调整磁珠悬液与样本比率在左右两侧的变化(左侧片段筛选比率总大于右侧片段筛选比率),来控制反应体系对某一范围内的核酸片段的回收。
(1)一次结合:将50 μL样本加入合适的离心管(编号A)中,再根据图1的右侧片段筛选比率加入特定体积的磁珠悬液,漩涡震荡混匀后于室温下静置5min;将离心管置于磁性分离器上至溶液变澄清,用移液器将上清转移至另一个新的离心管中(编号B),弃去磁珠。
注:样本量×右侧片段筛选比率=磁珠悬液加入量,如50 μL样本×0.60=30 μL磁珠悬液。
(2)二次结合:根据图1的左侧片段筛选比率,在上述离心管B中加入特定量(见注)的磁珠悬液,漩涡震荡混匀后室温下静置5min;将离心管置于磁性分离器上至溶液澄清,用移液器吸去上清。
注:样本量×(左侧片段筛选比率-右侧片段筛选比率)=磁珠悬液加入量,如50 μL样本×(0.80-0.60)=10μL磁珠悬液。
(3)洗涤:保持离心管B于磁性分离器上,加入200 μL 80%(v/v)乙醇,室温静置30 s后,用移液器吸去上清;重复该步骤一次。
注:最后一次洗涤后应尽可能除尽洗涤液。
(4)干燥:保持离心管B于磁性分离器上,风干至磁珠表面无明显光泽。
注:该步骤应避免磁珠干燥过度而影响洗脱效率。
(5)洗脱:向离心管B中加入30~40μL超纯水、10 mM Tris-HCl或TE,用移液器反复吹打10次,使磁珠与溶液充分混匀,将反应管于室温静置3~5 min,再将离心管置于磁性分离器至溶液变澄清,将上清液转移至新的离心管中,可直接用于后续研究或者置于-20℃冰箱长期保存。
注:用户可以根据实验需要调整洗脱液体积,但不低于20 μL。
图1. DNA片段筛选结果
|
注:图左为左侧片段筛选结果,图右为右侧片段筛选结果(样本溶在TE中)
注意事项
1.操作之前,请务必认真阅读本产品说明书。
2.磁珠悬液在保存过程中应避免冷冻、离心等操作。
3.建议使用质量好的移液器吸头和反应管,避免因粘附磁珠及溶液而造成损失。
4.从磁珠保存管中移取磁珠前应充分震荡重悬均匀。
5.磁珠洗脱前应彻底去除洗涤液,避免残留乙醇影响DNA洗脱效率。
6.请勿长时间干燥磁珠,以免引起不可逆的磁珠聚集以及降低核酸洗脱效率。
7.样品中含有其他盐离子、PEG等成分,会影响最终片段筛选大小。如按建议筛选比率,需是不含影响筛选成分的,例如溶解在超纯水、Tris、TE等。其他溶液,可根据具体情况进行筛选比率的调整。
8.本产品仅供研究使用。
表1. 筛选的核酸片段大小与磁珠加入量的比率
|
筛选片段平均大小 |
250 bp |
350 bp |
400 bp |
500 bp |
600 bp |
|
|
磁珠用量 |
第一次 |
0.80× |
0.70× |
0.60× |
0.55× |
0.50× |
|
第二次 |
0.20× |
0.20× |
0.20× |
0.15× |
0.15× |
|







 微信服务号
微信服务号